Gel Segumpal Amebocyte Lysate Berbilang Vial Ujian G52
Siri Bioendo G52 digunakan terutamanya dalam operasi eksperimenujian endotoksin bakteriasebagai prosedur Bioassay.
1. Maklumat Produk
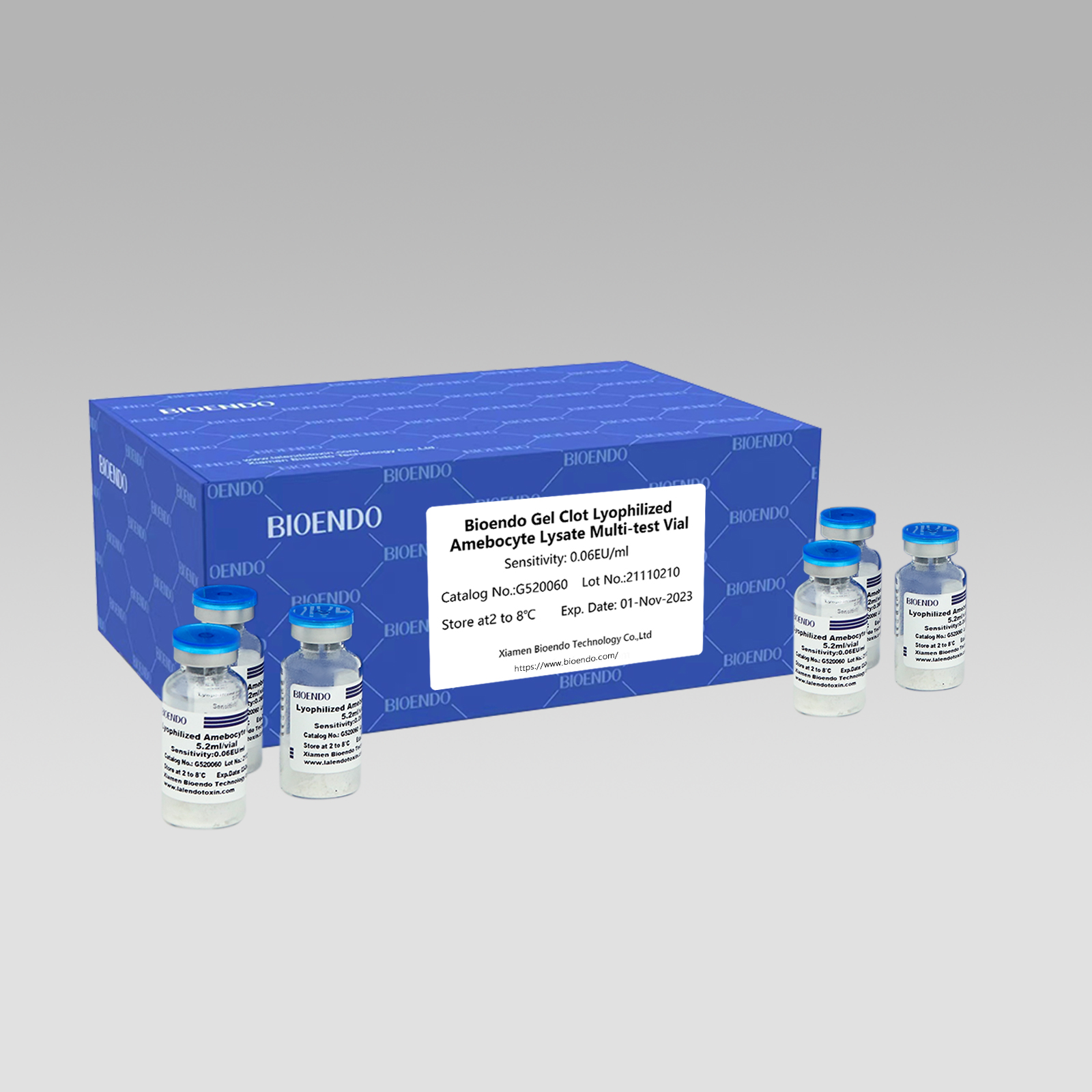
Kaedah Gel Clot Lyophilized Amebocyte Lysate Multi-test Vial ialah reagen Lyophilized Amebocyte Lysate yang memilih dan menggunakan teknik pembekuan gel untuk mengesan endotoksin atau pirogen.
Sebagai kaedah yang meluas, ujian bekuan gel untuk endotoksin adalah mudah dan tidak memerlukan instrumen khusus dan mahal.Bioendo menyediakan Gel Clot Lyophilized Amebocyte Lysate - reagen LAL dalam 5.2ml setiap vial.
2. Parameter Produk
Julat kepekaan: 0.03EU/ml, 0.06EU/ml, 0.125EU/ml, 0.25EU/ml, 0.5 EU/ml
3. Aplikasi Produk
Kelayakan endotoxin (pirogen) produk akhir, air untuk suntikanujian endotoksin, bahan mentahujian endotoksinatau pemantauan tahap endotoksin semasa proses pembuatan untuk syarikat farmaseutikal atau pengeluar peranti perubatan.
Catatan:
Lyophilized Amebocyte Lysate (reagen LAL) yang dihasilkan oleh Bioendo diperbuat daripada lisat amebosit (sel darah putih) daripada ketam ladam.
Reagen unik ini telah menjadi alat penting dalam industri farmaseutikal dan peranti perubatan untuk pengesanan endotoksin bakteria.Amebosit ketam ladam mengandungi bahan yang dipanggil Lyophilized Amebocyte Lysate, yang bertindak balas kepada endotoksin bakteria dengan membentuk bekuan seperti gel.Tindak balas ini adalah asas untuk ujian LAL, yang digunakan untuk memastikan keselamatan peranti perubatan, ubat-ubatan dan produk lain yang bersentuhan dengan tubuh manusia.
Penggunaan reagen LAL telah merevolusikan prosespengesanan endotoksindalam bidang perubatan daripada ujian ujian Rabit.Sensitiviti dan kekhususannya yang tiada tandingan menjadikannya komponen penting dalam kawalan kualiti dan jaminan keselamatan farmaseutikal, biologi dan peranti perubatan.Ujian LAL ialah kaedah yang pantas dan boleh dipercayai untukpengesanan endotoksin, memberikan hasil dalam masa 60 minit.Kecekapan ini membolehkan keputusan yang cepat dan tepat mengenai pengeluaran produk, akhirnya meningkatkan keselamatan dan keberkesanan keseluruhan rawatan dan peranti perubatan.
Lyophilized Amebocyte Lysate (reagen LAL) Bioendo dihasilkan di bawah standard kualiti yang ketat untuk memastikan keberkesanan dan kebolehpercayaannya.Syarikat itu berdedikasi untuk menggunakan amalan mampan dalam penuaian ketam ladam untuk meminimumkan sebarang kesan negatif terhadap populasi mereka.Dengan mengutamakan kebajikan makhluk ini, Bioendo memastikan bekalan berterusan sumber berharga ini untuk pengeluaran reagen LAL.Selain itu, usaha penyelidikan dan pembangunan yang berterusan tertumpu pada peningkatan prestasi dan kepelbagaianujian LAL endotoksin, memajukan lagi utiliti mereka dalam industri perubatan dan farmaseutikal.
Kaedah pembekuan gelUjian LAL, reagen lisat tersusun mendapat sekurang-kurangnya 50 ujian setiap vial:
| Nombor Katalog | Sensitiviti (EU/ml atau IU/ml) | ml/botol | Ujian/Vial | Vial/Pek |
| G520030 | 0.03 | 5.2 | 50 | 10 |
| G520060 | 0.06 | 5.2 | 50 | 10 |
| G520125 | 0.125 | 5.2 | 50 | 10 |
| G520250 | 0.25 | 5.2 | 50 | 10 |
| G520500 | 0.5 | 5.2 | 50 | 10 |
Keadaan produk:
Lyophilized Amebocyte Lysate - sensitiviti reagen LAL dan potensi Endotoksin Standard Kawalan diuji terhadap Endotoksin Standard Rujukan USP.Kit reagen Lyophilized Amebocyte disertakan dengan arahan produk, Sijil Analisis, MSDS.
Apakah perbezaan antara vial ujian tunggal Bioendo dan vial ujian berbilang?
● Ujian tunggal: membentuk semula tunggalujian limulus lysateatau dipanggillimulus amebositdengan air BET dalam botol kaca atau ampul kaca.
● Ujian berbilang: susun semula reagen lysate dengan air BET, dan kemudian tambahkan jumlah reagen lysate yang bertanda berikutan COA ke dalam tiub tindak balas atau plat perigi untuk digunakan.Tiada perbezaan dalam prosedur pra-pemprosesan sampel;mengikut jumlah ujian yang digunakan, saiz sampel yang digunakan untuk satu ujian adalah lebih besar daripada saiz sampel yang digunakan untuk pelbagai ujian.
Mengapakah kit ujian bekuan gel G52 khas untuk kuantiti sampel jisim?
1. Pelbagai ujian reagen LAL untuk pengesanan endotoksin dalam aplikasi prosedur operasi ujian LAL sampel jisim.
2. G52 siri Gel endotoksin assay multi test vial kaca tidak memerlukan pembaca plat mikro yang canggih.Dalam ujian LAL prosedur pengeramannya dengan mandi air atau inkubator haba kering adalah peranti yang mudah.
3. Kualiti akhir tinggi tiub bebas endotoksin (<0.005EU/ml) dan Kualiti tinggi petua bebas pirogen (<0.005EU/ml) sebagai bahan guna guna yang dijamin untuk memastikan hasil yang betul.
4. Untuk memilih vial ujian LAL tunggal Bioendo atau vial ujian LAL berbilang mengikut kuantiti sampel, sasarannya ialahUjian LAL untuk pirogenpengesanan.
Produk berkaitan dalam ujian ujian endotoksin:
Air untuk Ujian Endotoksin Bakteria (BET), Syorkan TRW50 atau TRW100
Tiub kaca bebas endotoksin ( tiub pencairan ), Syor T1310018 dan T107540
Petua bebas pyrogen, Syorkan PT25096 atau PT100096
Pipettor, Syorkan PSB0220
Rak Tabung Uji
Instrumen Pengeraman (Water Bath atau Dry Heat Incubator ), untuk mengesyorkan Bioendo Dry Heat Incubator TAL-M2 ialah 60 lubang satu modular.
Pengadun Vortex, Syorkan VXH.
Kawalan Endotoksin Standard, CSE10V.